- Investment
- 科学论坛
-
Program
- Recruitment
- Center
News Message
Nature:CAR-T 细胞免疫疗法
- by wittx 2023-07-12
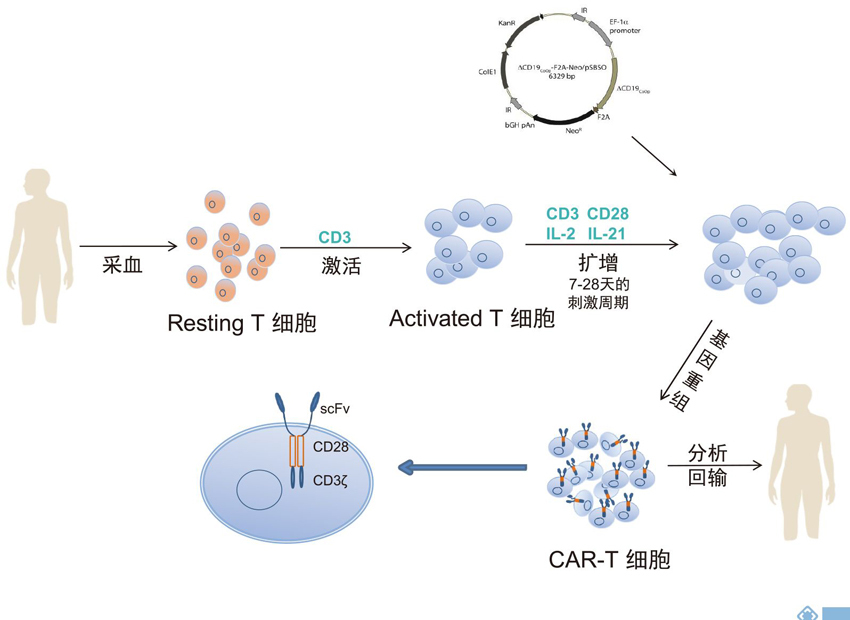
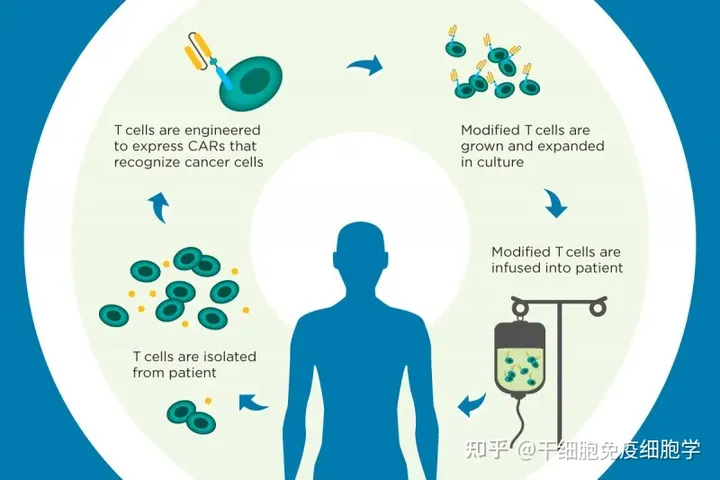
CAR-T治疗又称嵌合抗原受体T细胞治疗,是将人的T细胞经过基因工程手段体外修饰改造后,回输患者体内,用于治疗疾病。CAR-T技术逐渐发展,临床结果表明CAR-T细胞在治疗血液系统恶性肿瘤具有极大的优势。但随着研究的深入和应用的不断增多,CAR-T治疗产生的不良反应逐渐被认识和关注。
近日,Nature Reviews Cancer 发布一篇题为Recent advances and discoveries in the mechanisms and functions of CAR T cells,主要介绍了近三年CAR-T治疗过程中有效性和安全性问题。
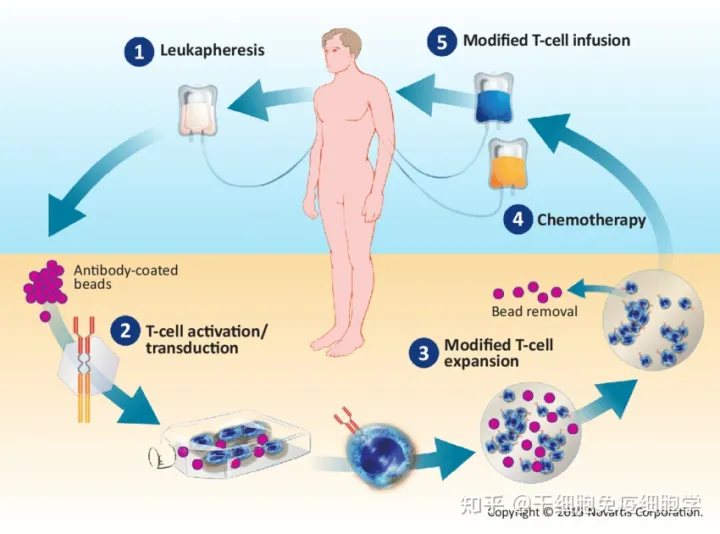
CAR-T细胞治疗
1
CAR-T细胞治疗
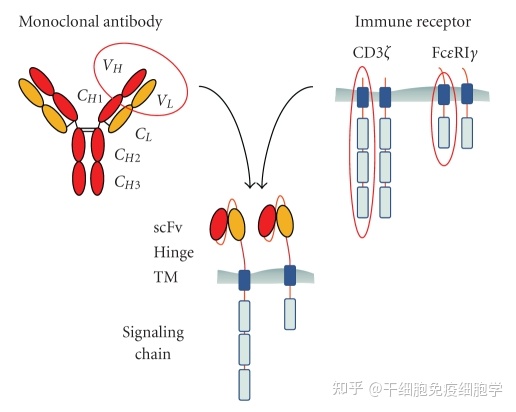
CAR-T细胞是抗体的单链可变区域(scFv)与T细胞表面受体嵌合于T细胞上,主要由三部分组成即胞外区、跨膜区和胞内区域。胞外区常为单链抗体(scFv),负责识别并结合靶抗原;跨膜区是铰链或间隔区,可将scFv锚定于细胞膜上;胞内信号域由共刺激因子和CD3信号域组成。当抗原被识别和结合后,产生刺激信号传至胞内信号域,T细胞被激活并发挥效应功能。
CAR-T的结构
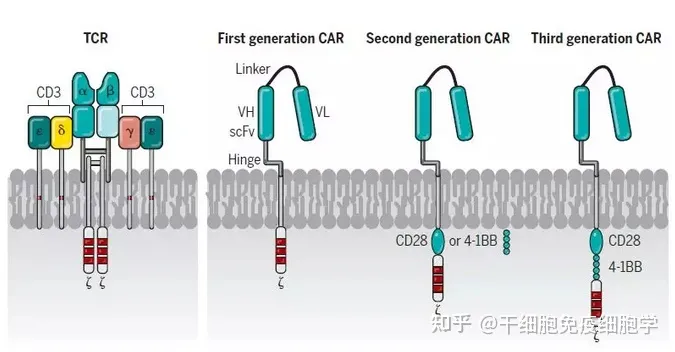
第一代CARs由胞外抗原识别区即单链可变片段(scFv)组成,融合跨膜区和T细胞受体(TCR)CD3ζ分子胞内信号域[1-4]。然而,由于一代CAR-T细胞扩增慢和持久性差,在临床试验中疗效甚微[5]。
第二代CARs包含一个共刺激域,其衍生自CD28或4-1BB结构域,位于跨膜区和CD3信号传导域之间。研究结果表明,靶向CD19二代CAR-T细胞在临床治疗中效果显著。2017年美国FDA批准首款靶向CD19二代CAR-T产品上市[6]。第三代CARs在第二代CAR基础上增加了一个共刺激域,增强T细胞信号转导,后续发展了多代CAR分子,在此不再赘述。
目前,FDA已批准了共4款CAR-T药物上市。CAR-T治疗为肿瘤治疗打开了新的大门。
第一代至第三代CAR-T
2
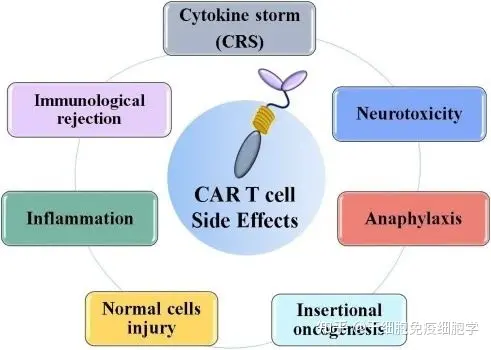
CAR-T细胞治疗的毒副作用
俗话说“是药三分毒”,在CAR-T治疗过程中,也会出现副作用,临床上常见的是细胞因子风暴(CRS)和神经毒性(Neurotoxicity)。CRS患者通常在CAR-T细胞治疗的第一周内表现为发热、低血压和呼吸功能不全,并伴有高细胞因子水平;神经毒性表现为暂时性工作记忆丧失、神志不清、癫痫发作等。
CAR-T治疗的副作用
解决措施
- 干预细胞因子,抗体阻断IL-1、IL-6和GM-CSF,阻断过度炎症反应。
- 控制T细胞的过度激活,采用酪氨酸激酶抑制剂,阻断激活信号传导。
- 化学药物阻断细胞因子的过度释放,采用甲胺酸阻断儿茶酚胺样作用。
3
CAR-T细胞治疗的抗性问题
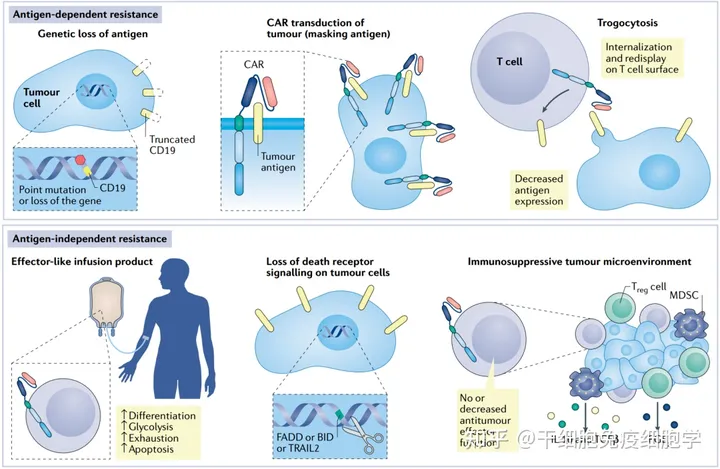
除毒性反应外,CAR-T治疗过程中也会产生抗性的问题,根据机制的不同可分为抗原依赖性和非抗原依赖性两方面。
抗原依赖性
导致原因:
- 靶抗原丢失( 指CAR分子能够从肿瘤细胞上移除目标抗原,并将其内化,降低肿瘤细胞上的抗原密度)。
- 靶抗原的基因突变导致靶标不能被有效识别。
- 靶抗原表位被遮蔽。
解决措施:(1)设计多靶向的CAR分子;(2)增加靶抗原的表达;(3)提高scFv与靶抗原的亲和力,可能有助于CAR-T细胞识别低密度的靶抗原。
非抗原依赖性
导致原因:
- T细胞表面死亡受体缺失,造成T细胞过度耗竭。
- 肿瘤细胞表面配体分子缺失,如FAS相关死亡蛋白(FADD)、肿瘤坏死因子相关凋亡诱导配体-2(TRAIL-2)的缺失使肿瘤细胞在体外和体内对CAR-T细胞更具抵抗作用。
解决措施:
- 阻断免疫抑制检查点,阻止T细胞耗竭,可修饰CAR-T细胞上的PD-1分子,在细胞表面表达PD-1的显性负性受体或采用CRISPR-Cas9基因编辑技术敲除T细胞上PD-1的基因。
- 提高CAR-T细胞的增殖能力、持久性和抗瘤活性,可在CAR-T细胞上表达IL-7受体。
- 改变T细胞终末状态的分化,研究表明过表达c-Jun AP1转录因子可以降低T细胞耗竭[7]。
肿瘤微环境(TME)
肿瘤免疫抑制微环境包括免疫抑制细胞(如Treg细胞、髓系抑制细胞)和抑制分子(如TGF-β、IL-6、IL-10和PGE-2)能够抑制CAR-T细胞。
解决措施:(1)增强CAR-T细胞的浸润能力,可过表达IL-7和CCL-19。(2)改变T reg介导免疫抑制作用。
抗原依赖性和抗原非依赖性抗性机制
4
CAR-T细胞治疗研究进展
新靶点和新资料CAR-T
多发骨髓瘤:新靶点GPRC5D(G蛋白偶联受体)、CD38、CD138、SLAMF7
泛癌:免疫检查点分子B7-H3(CD276)、Tn-PDPN等
脑瘤:氯毒素肽
新的治疗靶点和治疗产品
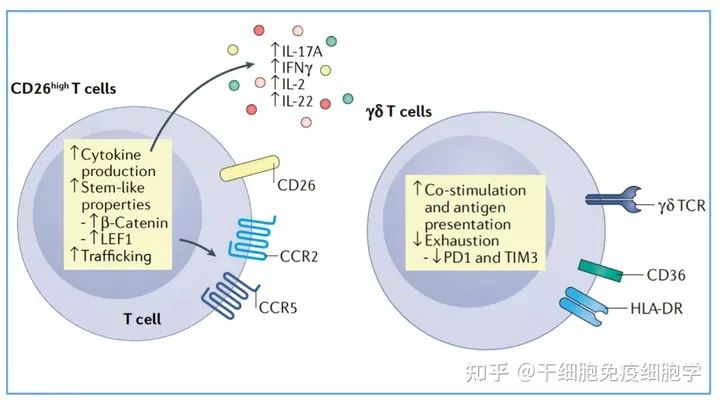
此外,某些特定T细胞亚群修饰的CAR-T细胞可能会产生较好的效果。
CD26highCAR-T细胞,能够产生IL-17A、IFN-γ、IL-2和IL-22,细胞表面表达CCR2和CCR5,具记忆干细胞样特性。
γδT细胞来源的CAR-T细胞,γδT细胞能耐受T细胞耗竭,其表面抑制性受体(TIM3和PD-1)表达水平较低,能够交叉递呈肿瘤抗原。
细胞亚群的选择
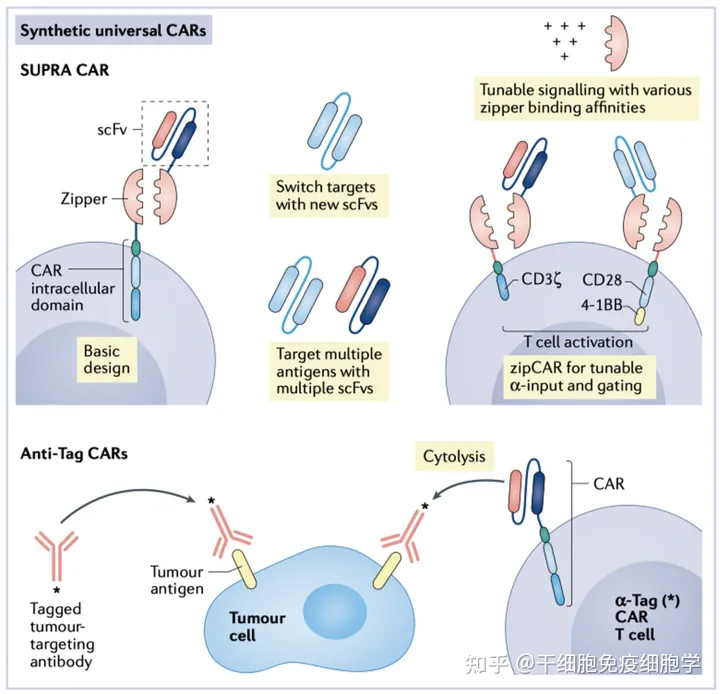
通用型细胞治疗
通用型细胞治疗是未来发展的方向,其主要难点是GvHD宿主抗移植物反应。宿主抗移植物反应与TCR上的HLA基因相关。通用CAR细胞治疗,一种思路是编辑修饰相关基因,如TALEN基因编辑的TCR-α基因或者CRISPR-Cas9基因编辑敲除TCR上的HLA基因;另一种思路是设计CAR分子,zipper-CAR系统通过zipper蛋白的受体和配体桥接scFv和CAR分子胞内结构,通过更换不同的scFv设计靶向多抗原的通用CAR。
通用型CAR-T系统
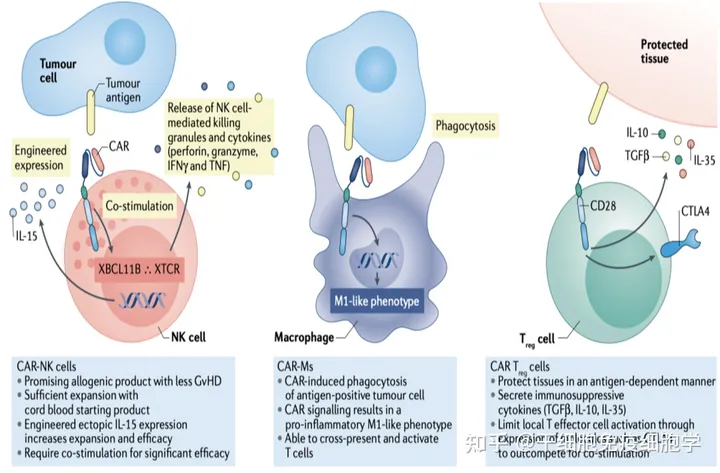
CAR-X细胞治疗
CAR-NK:NK细胞是自然杀伤细胞,具有天然的抗肿瘤作用。其优点是无MHC限制性,安全性较高,可制备同种异体细胞,CAR-NK是通用型细胞治疗一个比较好的选择。CAR-M(巨噬细胞):巨噬细胞具有抗原特异性吞噬和促炎极化作用,能交叉递呈抗原并激活T细胞。研究表明CAR-M巨噬细胞在小鼠肺癌转移模型中展示了较强的抗肿瘤活性。CAR-Treg:Treg细胞能够分泌免疫抑制分子TGFβ, IL -10, IL-35,可用于治疗自身免疫性疾病和器官移植的排斥反应,也可防止T细胞过度激活。
新型CAR细胞设计
5
文末小结
CAR-T细胞治疗已发展了三十余年,临床上也取得了较好的治疗效果。但风险与机遇并存,CAR-T细胞治疗中也表现出了潜在的毒性和耐药性问题,由此加速了寻找肿瘤新靶点、研究信号机制和开发新技术的步伐。在CAR分子设计、转导方法和选择最佳细胞类型方面的创新可能会带来新的突破,改变未来肿瘤的治疗方式,细胞治疗未来可期。
参考文献:1.Stancovski, I. et al. Targeting of T lymphocytes to Neu/HER2-expressing cells using chimeric single-chain Fv receptors. J. Immunol. 151, 6577–6582 (1993).
2.Eshhar, Z. et al. The T-body approach: potential for cancer immunotherapy. Springer Semin.Immunopathol. 18, 199–209 (1996).3.Hwu, P. et al. Lysis of ovarian cancer cells by human lymphocytes redirected with a chimeric gene composed of an antibody variable region and the Fc receptor γ chain. J.Exp. Med. 178, 361–366 (1993).4.Hwu, P. et al. In vivo antitumor activity of T cells redirected with chimeric antibody/T-cell receptor genes. Cancer Res. 55, 3369–3373 (1995).5.Kershaw, M. H. et al. A phase I study on adoptive immunotherapy using gene-modified T cells for ovarian cancer. Clin. Cancer Res. 12, 6106–6115 (2006).6.Mullard, A. FDA approves first CAR T therapy.Nat. Rev. Drug Discov. 16, 669–669 (2017).7.Lynn, R. C. et al. c-Jun overexpression in CAR T cells induces exhaustion resistance. Nature 576, 293–300 (2019).
Share Http URL: http://www.wittx.cn/get_news_message.do?new_id=1194
Best Last Month

Information industry by show

Information industry by wittx
Electronic electrician by wittx

Information industry by wittx

Information industry by wittx

Information industry by show
Information industry by wittx
Medical science by wittx
Information industry by wittxLLMs模型(GPTs、LaMDA、GLM/ChatGLM、PaLM/Flan-PaLM、BLOOM、LLaMA、Alpaca)
Information industry by wittx