
- Investment
- 科学论坛
-
Program
- Recruitment
- Center
News Message
首个套细胞淋巴瘤 CAR-T细胞疗法 吉利德Tecartus获美国FDA批准
- by wittx 2020-08-15
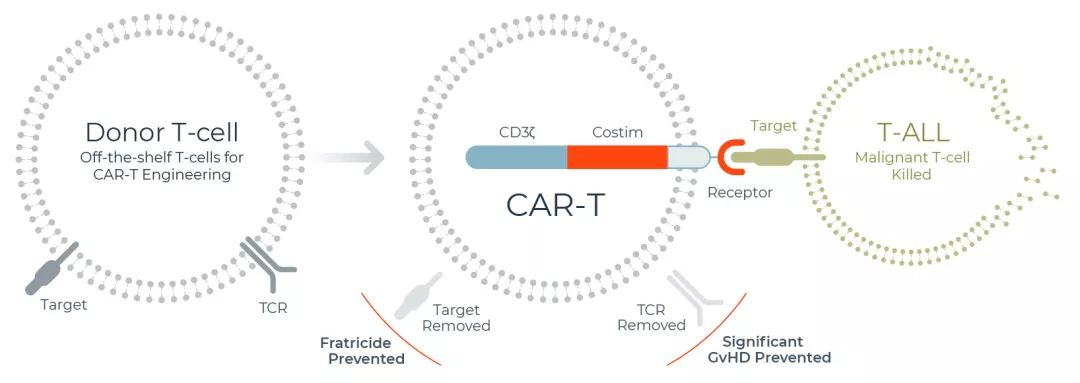
2020年07月25日讯 /生物谷BIOON/ --吉利德(Gilead)旗下T细胞治疗公司Kite近日宣布,美国食品和药物管理局(FDA)已加速批准Tecartus(brexucabtagene autoleucel,前称KTE-X19),这是一种嵌合抗原受体T细胞疗法(CAR-T),用于治疗复发或难治性套细胞淋巴瘤(R/R MCL)成人患者。在关键ZUMA-2临床试验中,Tecartus单次输注治疗的客观缓解率(ORR)为87%、完全缓解率(CR)为67%。
目前,Tecartus也正在接受欧洲药品管理局(EMA)的审查。在美国和欧盟,Tecartus之前分别被授予了突破性药物资格(BTD)和优先药物资格(PRIME)。MCL是一种罕见的非霍奇金淋巴瘤(NHL),起源于淋巴结“套区”的细胞,通常影响60岁以上的男性。MCL在复发后具有高度侵袭性,许多患者在治疗期间病情逐步进展。
值得一提的是,Tecartus是第一个也是唯一一个被批准治疗R/R MCL的CAR-T疗法,将为患者带来一种变革性的治疗方法。而随着此次批准,Kite也成为了第一家拥有多个商业化CAR-T疗法的生物制药公司。
Tecartus将在Kite位于加利福尼亚州埃尔塞贡多的商业制造工厂生产。在ZUMA-2试验中,Kite展示了高达96%的制造成功率以及从白细胞分离术(leukapheresis)到产品交付平均15天的生产周转时间。制造速度对晚期疾病患者尤其重要,其病情严重,有快速恶化的风险。
Tecartus的产品标签中含有一则黑框警告,提示细胞因子释放综合征(CRS)和神经毒性风险。该药的风险评估和减灾战略(REMS)已被FDA批准,并已与Kite另一款CAR-T细胞疗法Yescarta的REMS合并。
Share Http URL: http://www.wittx.cn/get_news_message.do?new_id=344
Best Last Month
.jpg)
Information industry by wittx
Electronic electrician by wittx
.jpg)
Information industry by wittx
Information industry by show
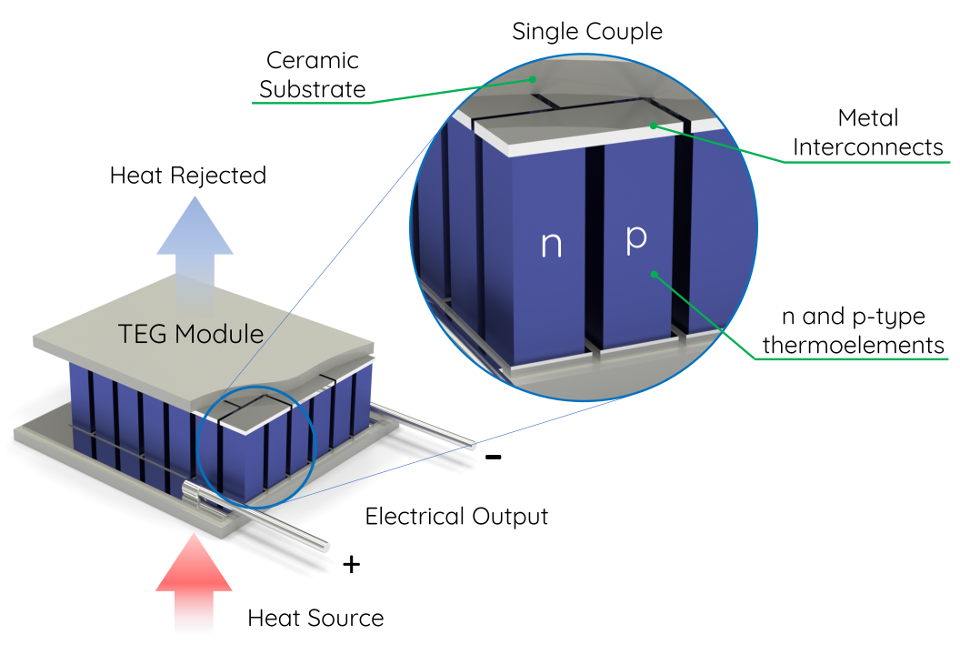
Information industry by wittxThree dimensional architected thermoelectric devices with high toughness and power conversion effici

Information industry by wittx

Information industry by wittx
Information industry by wittx

Information industry by wittx
Information industry by wittx
